Ako je polazna kiselina polibazna, tada je moguća tvorba ili punih estera - sve HO skupine su zamijenjene, ili kiselih estera - djelomična supstitucija. Za monobazične kiseline mogući su samo puni esteri (slika 1).
Riža. 1. PRIMJERI ESTERA na bazi anorganske i karboksilne kiseline
Nomenklatura estera.
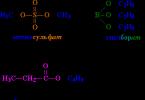
Naziv se stvara na sljedeći način: prvo se navodi skupina R vezana za kiselinu, zatim naziv kiseline s nastavkom "at" (kao u imenima anorganskih soli: ugljik na natrij, nitrat na krom). Primjeri na sl. 2

Riža. 2. NAZIVI ESTERA. Fragmenti molekula i odgovarajući fragmenti naziva istaknuti su istom bojom. Esteri se obično smatraju produktima reakcije između kiseline i alkohola; na primjer, butil propionat se može smatrati rezultatom reakcije između propionske kiseline i butanola.
Ako koristite trivijalni ( cm. TRIVIJALNI NAZIVI TVARI) naziv polazne kiseline, tada naziv spoja uključuje riječ "ester", na primjer, C 3 H 7 COOC 5 H 11 - amil ester maslačne kiseline.
Podjela i sastav estera.
Među proučavanim i široko korištenim esterima većina su spojevi izvedeni iz karboksilnih kiselina. Esteri na bazi mineralnih (anorganskih) kiselina nisu tako raznoliki, jer klasa mineralnih kiselina manje je brojna od karboksilnih kiselina (raznolikost spojeva jedno je od obilježja organske kemije).
Kada broj C atoma u izvornoj karboksilnoj kiselini i alkoholu ne prelazi 6-8, odgovarajući esteri su bezbojne uljaste tekućine, najčešće voćnog mirisa. Oni čine skupinu voćnih estera. Ako je aromatski alkohol (koji sadrži aromatsku jezgru) uključen u stvaranje estera, tada takvi spojevi, u pravilu, imaju cvjetni, a ne voćni miris. Svi spojevi iz ove skupine praktički su netopivi u vodi, ali su lako topljivi u većini organskih otapala. Ovi spojevi zanimljivi su zbog svoje široke palete ugodnih aroma (tablica 1), a neki od njih su najprije izolirani iz biljaka, a kasnije sintetizirani umjetnim putem.
| Stol 1. NEKI ESTERI, s voćnom ili cvjetnom aromom (fragmenti izvornih alkohola u formuli spoja i u nazivu označeni su masnim slovima) | ||
| Formula estera | Ime | Aroma |
| CH 3 COO C 4 H 9 | Butil acetat | kruška |
| C3H7COO CH 3 | Metil Ester maslačne kiseline | jabuka |
| C3H7COO C 2 H 5 | Etil Ester maslačne kiseline | ananas |
| C4H9COO C 2 H 5 | Etil | grimizna |
| C4H9COO C 5 H 11 | Isoamil ester izovalerijanske kiseline | banana |
| CH 3 COO CH2C6H5 | Benzil acetat | jasmin |
| C6H5COO CH2C6H5 | Benzil benzoat | cvjetni |
Kada se veličina organskih skupina uključenih u estere poveća na C 15-30, spojevi poprimaju konzistenciju plastičnih, lako omekšanih tvari. Ova skupina se naziva voskovi; obično su bez mirisa. Pčelinji vosak sadrži mješavinu različitih estera, a jedna od komponenti voska, koji je izoliran i određen mu je sastav, je miricil ester palmitinske kiseline C 15 H 31 COOC 31 H 63. Kineski vosak (proizvod izlučivanja košenile - insekata istočne Azije) sadrži ceril ester cerotične kiseline C 25 H 51 COOC 26 H 53. Osim toga, voskovi također sadrže slobodne karboksilne kiseline i alkohole, koji uključuju velike organske skupine. Voskovi se ne močiju vodom i topljivi su u benzinu, kloroformu i benzenu.
Treća skupina su masti. Za razliku od prethodne dvije skupine bazirane na monohidričnim alkoholima ROH, sve masti su esteri nastali iz trohidričnog alkohola glicerola HOCH 2 – CH (OH) – CH 2 OH. Karboksilne kiseline koje čine masti obično imaju ugljikovodični lanac s 9-19 ugljikovih atoma. Životinjske masti (kravlji maslac, janjetina, mast) su plastične, topljive tvari. Biljne masti (maslinovo, pamučno, suncokretovo ulje) su viskozne tekućine. Životinjske masti uglavnom se sastoje od mješavine glicerida stearinske i palmitinske kiseline (slika 3A, B). Biljna ulja sadrže gliceride kiselina s nešto kraćim ugljikovim lancem: laurinske C 11 H 23 COOH i miristinske C 13 H 27 COOH. (poput stearinske i palmitinske kiseline, ovo su zasićene kiseline). Takva se ulja mogu dugo čuvati na zraku bez promjene konzistencije, pa se stoga nazivaju nesušivim. Nasuprot tome, laneno ulje sadrži glicerid nezasićene linolne kiseline (Slika 3B). Kada se nanese u tankom sloju na površinu, takvo se ulje suši pod utjecajem atmosferskog kisika tijekom polimerizacije duž dvostrukih veza i stvara se elastični film netopljiv u vodi i organskim otapalima. Prirodno sušivo ulje se proizvodi od lanenog ulja.

Riža. 3. GLICERIDI STEARINSKE I PALMITINSKE KISELINE (A I B)– komponente životinjske masti. Glicerid linolne kiseline (B) je sastojak lanenog ulja.
Esteri mineralnih kiselina (alkil sulfati, alkil borati koji sadrže fragmente nižih alkohola C 1–8) su uljaste tekućine, esteri viših alkohola (počevši od C 9) čvrsti su spojevi.
Kemijska svojstva estera.
Za estere karboksilnih kiselina najkarakterističnije je hidrolitičko (pod utjecajem vode) cijepanje esterske veze; u neutralnoj sredini ono se odvija sporo, a zamjetno ubrzava u prisutnosti kiselina ili baza, jer H + i HO – ioni kataliziraju ovaj proces (slika 4A), pri čemu hidroksilni ioni djeluju učinkovitije. Hidroliza u prisutnosti lužina naziva se saponifikacija. Ako uzmete količinu lužine dovoljnu da neutralizira svu nastalu kiselinu, dolazi do potpune saponifikacije estera. Ovaj se proces provodi u industrijskim razmjerima, a glicerol i više karboksilne kiseline (C 15–19) dobivaju se u obliku soli alkalnih metala, koje su sapun (slika 4B). Fragmenti nezasićenih kiselina sadržani u biljnim uljima, kao i svi nezasićeni spojevi, mogu se hidrogenirati, vodik se veže na dvostruke veze i nastaju spojevi slični životinjskim mastima (slika 4B). Ovom metodom se industrijski proizvode čvrste masti na bazi suncokretovog, sojinog ili kukuruznog ulja. Margarin se proizvodi od produkata hidrogenizacije biljnih ulja pomiješanih s prirodnim životinjskim mastima i raznim prehrambenim dodacima.

Glavna metoda sinteze je interakcija karboksilne kiseline i alkohola, koju katalizira kiselina i prati oslobađanje vode. Ova reakcija je suprotna od one prikazane na Sl. 3A. Da bi se proces odvijao u željenom smjeru (sinteza estera), voda se destilira (destilira) iz reakcijske smjese. Posebnim studijama s obilježenim atomima bilo je moguće utvrditi da se tijekom procesa sinteze O atom, koji je dio nastale vode, odvaja od kiseline (označeno crvenim točkastim okvirom), a ne od alkohola ( nerealizirana opcija je istaknuta plavim točkastim okvirom).
Koristeći istu shemu, dobivaju se esteri anorganskih kiselina, na primjer, nitroglicerina (slika 5B). Umjesto kiselina mogu se koristiti kiselinski kloridi, metoda je primjenjiva i za karboksilne (Slika 5C) i za anorganske kiseline (Slika 5D).
Interakcija soli karboksilnih kiselina s RCl halogenidima također dovodi do estera (slika 5D); reakcija je prikladna jer je ireverzibilna - oslobođena anorganska sol odmah se uklanja iz organskog reakcijskog medija u obliku taloga.
Upotreba estera.
Etil format HCOOC 2 H 5 i etil acetat H 3 COOC 2 H 5 koriste se kao otapala za celulozne lakove (na bazi nitroceluloze i celuloznog acetata).
Esteri na bazi nižih alkohola i kiselina (tablica 1) koriste se u prehrambenoj industriji za izradu voćnih esencija, a esteri na bazi aromatskih alkohola u industriji parfema.
Od voskova se izrađuju sredstva za poliranje, maziva, sastavi za impregniranje papira (voštanog papira) i kože, a ulaze i u kozmetičke kreme i ljekovite masti.
Masti, zajedno s ugljikohidratima i bjelančevinama, čine skup namirnica potrebnih za prehranu, ulaze u sastav svih biljnih i životinjskih stanica, osim toga, akumulirajući se u tijelu, igraju ulogu rezerve energije. Zbog niske toplinske vodljivosti, masni sloj dobro štiti životinje (osobito morske životinje - kitove ili morževe) od hipotermije.
Životinjske i biljne masti su sirovine za proizvodnju viših karboksilnih kiselina, deterdženata i glicerola (slika 4), koriste se u kozmetičkoj industriji i kao sastavni dio raznih maziva.
Nitroglicerin (slika 4) je poznata droga i eksploziv, osnova dinamita.
Sušivo ulje se proizvodi od biljnih ulja (slika 3), koja čine osnovu uljanih boja.
Esteri sumporne kiseline (slika 2) koriste se u organskoj sintezi kao alkilirajući (uvođenje alkilne skupine u spoj) reagensi, a esteri fosforne kiseline (slika 5) koriste se kao insekticidi, te kao dodaci mazivim uljima.
Mihail Levitski
Esteri su derivati oksokiselina (i karboksilnih i mineralnih) RkE(=O)l(OH)m, (l ≠ 0), formalno su produkti zamjene hidroksilnih vodikovih atoma -OH kisele funkcije ugljikovodičnim ostatkom ( alifatski, alkenil, aromatski ili heteroaromatski); također se smatraju acilnim derivatima alkohola. U nomenklaturi IUPAC-a, esteri također uključuju acilne derivate halkogenidnih analoga alkohola (tiola, selenola i telurena).
Razlikuju se od etera u kojima su dva ugljikovodična radikala povezana atomom kisika (R1-O-R2).
Opća formula estera:
Nomenklatura estera.
Naziv se stvara na sljedeći način: prvo se navodi skupina R vezana za kiselinu, zatim naziv kiseline s nastavkom "at" (kao u imenima anorganskih soli: ugljik na natrij, nitrat na krom). Primjeri na sl. 2
Riža. 2. NAZIVI ESTERA. Fragmenti molekula i odgovarajući fragmenti naziva istaknuti su istom bojom. Esteri se obično smatraju produktima reakcije između kiseline i alkohola; na primjer, butil propionat se može smatrati rezultatom reakcije između propionske kiseline i butanola.
Ako se koristi trivijalni naziv polazne kiseline, tada je riječ "ester" uključena u naziv spoja, na primjer, C 3 H 7 COOC 5 H 11 - amil ester maslačne kiseline.
Homologne serije estera.
Opća formula estera je R1--CO---R2, gdje su R1 i R2 ugljikohidratni radikali. Esteri su derivati kiselina u kojima je H u hidroksilnoj skupini zamijenjen radikalom. Esteri su dobili naziv po svojim kiselinama i alkoholima. koji sudjeluju u obrazovanju
H-CO-O-CH3-- metil format ili ester metil mravlje kiseline ili metil ester mravlje kiseline.
CH3-CO-O-C2H5 - etil acetat ili etil ester octene kiseline ili octeni etil eter..
C3H7-CO-O-CH3 - metil ester maslačne kiseline ili metil butirat
C3H7-CO-O-C2H5 - etil ester maslačne kiseline ili etil butirat
Ukratko, trebate napisati tablicu karboksilnih kiselina. a njima i naziv soli (mravlja – format, octena – acetat, propionska – propinat, butirat, valerijanska – valerijat, kapronska – kapronat, enantna – enantonat, oksalna – oksalat, malonska – malonat, sukcinska – sukcinat.... Pogledajte Kako nastaju imena etera?
CH3- CO-O (ovo je octena kiselina bez H) --C5H11- (ovo je monovalentni pentil (amil) radikal - tablica) ovo je naziv ovog estera.
Amil acetat ester, amin ester octene kiseline, amil acetat. Pogledaj opet.
CH3CH2CH2CH2-CO-O (pentan ili valerijanska kiselina) ---C4H9 (ovo je butil) - butil valerat, valerijanski butil eter, butil ester valerijanske kiseline.
Izomerija.
Estere karakterizira izomerija ugljikovodičnog skeleta. Na primjer, izomeri su propil acetat i izopropil acetat. Budući da molekula estera sadrži dva ugljikovodična radikala - kiselinski ostatak i alkoholni ostatak - moguća je izomerija svakog od radikala. Na primjer, izomeri su propil acetat i izopropil acetat (izomerija u alkoholnom radikalu) ili etil butirat i etil izobutirat (izomerija u kiselom radikalu).
Fizička svojstva. Esteri su bezbojne tekućine, slabo topljive ili uopće netopljive u vodi i imaju specifičan miris (u niskim koncentracijama - ugodan, često voćni ili cvjetni). Esteri viših alkohola i viših kiselina su krutine.
Kemijska svojstva . Najkarakterističnija reakcija za estere je hidroliza. Hidroliza se događa u prisutnosti kiselina ili lužina. Kad se ester hidrolizira u prisutnosti kiselina, nastaju karboksilna kiselina i alkohol:
Kada se ester hidrolizira u prisutnosti lužina, nastaju sol karboksilne kiseline i alkohol:
Metode dobivanja.
Metode dobivanja estera. Glavni proizvodi i njihova područja primjene. Uvjeti za reakciju esterifikacije organskih kiselina s alkoholima. Procesni katalizatori. Značajke tehnološkog dizajna jedinice reakcije esterifikacije.
1. Interakcija kiselina s alkoholima:
Ovo je najčešća metoda za proizvodnju estera.
2. Sinteza estera kondenzacijom aldehida:
Sinteza estera iz aldehida (Tishchenkova reakcija) provodi se u prisutnosti aluminijevog alkoksida aktiviranog željeznim kloridom ili, bolje, aluminijevim kloridom i cinkovim oksidom. Ova metoda je od industrijske važnosti.
3. Adicija organskih kiselina na alkene:
4. Sinteza estera dehidrogenacijom alkohola:
5. Dobivanje estera transesterifikacijom.
Ova reakcija ima dvije varijante: reakcija izmjene između etera i alkohola s alkoholnim radikalima (reakcija alkoholize):
i reakcija izmjene kiselinskih radikala na alkoholnoj skupini estera:
6. Sinteza estera iz kiselinskih anhidrida i alkohola:
7. Interakcija ketona s alkoholima:
8. Interakcija između kiselih halogenida i alkohola:
9. Reakcija između srebrovih ili kalijevih soli kiselina i derivata alifatskih halogenida:
10. Interakcija kiselina s alifatskim diazo spojevima
Primjena.
Neki se esteri koriste kao otapala (etil acetat je od najvećeg praktičnog značaja). Mnogi se esteri, zbog ugodnog mirisa, koriste u prehrambenoj te parfimersko-kozmetičkoj industriji. Esteri nezasićenih kiselina koriste se za proizvodnju pleksiglasa, a najviše se koristi metil metakrilat.
Na temu
"Esteri i esteri"
Izvršio: Manzhieva A.A.
Derivati karboksilnih ili anorganskih kiselina u kojima je atom vodika u hidroksilnoj skupini zamijenjen radikalom nazivaju se esteri. Tipično, opća formula estera označava se kao dva ugljikovodična radikala vezana na karboksilnu skupinu - C n H 2n+1 -COO-C n H 2n+1 ili R-COOR’.
Nomenklatura
Imena estera sastavljena su od naziva radikala i kiseline sa sufiksom “-at”. Na primjer:
- CH3COOH- metil format;
- HCOOCH 3- etil format;
- CH 3 COOC 4 H 9- butil acetat;
- CH3-CH2-COO-C4H 9- butilpropionat;
- CH3-SO4-CH3- dimetil sulfat.
Također se koriste trivijalni nazivi za kiselinu sadržanu u spoju:
- C 3 H 7 SOOS 5 H 11- amil ester maslačne kiseline;
- HCOOCH 3- metil ester mravlje kiseline;
- CH3-COO-CH2-CH(CH3) 2- izobutil ester octene kiseline.

Riža. 1. Strukturne formule estera s nazivima.
Klasifikacija
Ovisno o porijeklu esteri se dijele u dvije skupine:
- esteri karboksilne kiseline- sadrže ugljikovodične radikale;
- esteri anorganskih kiselina- uključuju ostatak mineralnih soli (C2H5OSO2OH, (CH3O)P(O)(OH)2, C2H5ONO).
Najraznovrsniji su esteri karboksilnih kiselina. Njihova fizička svojstva ovise o složenosti njihove strukture. Esteri nižih karboksilnih kiselina su hlapljive tekućine ugodne arome, dok su esteri viših karboksilnih kiselina krutine. To su slabo topivi spojevi koji plutaju na površini vode.
Vrste estera karboksilnih kiselina dane su u tablici.
|
Pogled |
Opis |
Primjeri |
|
Voćni esteri |
Tekućine čije molekule ne sadrže više od osam ugljikovih atoma. Imaju voćnu aromu. Sastoji se od monohidričnih alkohola i karboksilnih kiselina |
|
|
Tekućine (ulja) i krutine koje sadrže od devet do 19 atoma ugljika. Sastoje se od ostataka glicerola i karboksilne (masne) kiseline |
Maslinovo ulje je mješavina glicerina s ostacima palmitinske, stearinske, oleinske, linolne kiseline |
|
|
Krutine s 15-45 ugljikovih atoma |
CH3(CH2)14-CO-O-(CH2)29CH3-miricil palmitat |

Riža. 2. Vosak.
Esteri karboksilnih kiselina glavna su komponenta aromatičnih eteričnih ulja, koja se nalaze u voću, cvijeću i bobicama. Također uključeno u pčelinji vosak.

Riža. 3. Eterična ulja.
Priznanica
Esteri se pripremaju na nekoliko načina:
- reakcija esterifikacije karboksilnih kiselina s alkoholima:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O;
- reakcija anhidrida karboksilnih kiselina s alkoholima:
(CH 3 CO) 2 O + 2C 2 H 5 OH → 2CH 3 COOC 2 H 5 + H 2 O;
- reakcija soli karboksilnih kiselina s halogeniranim ugljikovodicima:
CH 3 (CH 2) 10 COONa + CH 3 Cl → CH 3 (CH 2) 10 COOCH 3 + NaCl;
- reakcija adicije karboksilnih kiselina na alkene:
CH 3 COOH + CH 2 =CH 2 → CH 3 COOCH 2 CH 3 + H 2 O.
Svojstva
Kemijska svojstva estera rezultat su -COOH funkcionalne skupine. Glavna svojstva estera opisana su u tablici.
Esteri se koriste u kozmetologiji, medicini i prehrambenoj industriji kao arome, otapala i punila.
Što smo naučili?
Iz teme sata kemije 10. razreda naučili smo što su esteri. To su spojevi koji sadrže dva radikala i karboksilnu skupinu. Ovisno o podrijetlu, mogu sadržavati ostatke mineralnih ili karboksilnih kiselina. Esteri karboksilnih kiselina dijele se u tri skupine: masti, voskovi, voćni esteri. To su slabo topljive tvari u vodi niske gustoće i ugodne arome. Esteri reagiraju s alkalijama, vodom, halogenima, alkoholima i amonijakom.
Test na temu
Ocjena izvješća
Prosječna ocjena: 4.6. Ukupno primljenih ocjena: 88.
Esteri– funkcionalni derivati karboksilnih kiselina,
u molekulama u kojima je hidroksilna skupina (-OH) zamijenjena alkoholnim ostatkom (-OR)
Esteri karboksilnih kiselina – spojevi opće formule
R-COOR",gdje su R i R" ugljikovodični radikali.
Esteri zasićenih monobazičnih karboksilnih kiselina imaju opću formulu:
Fizička svojstva:
Isparljive, bezbojne tekućine
· Slabo topljiv u vodi
· Najčešće ugodnog mirisa
Lakši od vode
Esteri se nalaze u cvijeću, voću i bobicama. Oni određuju njihov specifičan miris.
Sastavni su dio eteričnih ulja (poznato ih je oko 3000 e.m. – naranče, lavande, ruže i dr.)
Esteri nižih karboksilnih kiselina i nižih monohidričnih alkohola imaju ugodan miris po cvijeću, bobicama i voću. Osnova prirodnih voskova su esteri viših jednobazičnih kiselina i viših jednohidroksilnih alkohola. Na primjer, pčelinji vosak sadrži ester palmitinske kiseline i miricilnog alkohola (miricil palmitat):
CH 3 (CH 2) 14 –CO–O-(CH 2) 29 CH 3
|
Aroma. Strukturna formula. |
Ime Ester |
|
Jabuka
|
Etil eter 2-metilbutanska kiselina |
|
Trešnja
|
Amil ester mravlje kiseline |
|
Kruška
|
Izoamil ester octene kiseline |
|
Ananas |
Etil ester maslačne kiseline (etil butirat) |
|
Banana
|
Izobutil ester octene kiseline (g izoamil acetat također podsjeća na miris banane) |
|
Jasmin
|
Benzil eter acetat (benzil acetat) |
Kratki nazivi estera temelje se na nazivu radikala (R") u alkoholnom ostatku i nazivu RCOO skupine u kiselinskom ostatku. Na primjer, etil octena kiselina CH 3 COO C 2 H 5 nazvao etil acetat.
Primjena
· Kao mirisi i pojačivači mirisa u prehrambenoj i parfumerijskoj industriji (proizvodnja sapuna, parfema, krema);
· U proizvodnji plastike i gume kao plastifikatori.
Plastifikatori – tvari koje se uvode u sastav polimernih materijala radi davanja (ili povećanja) elastičnosti i (ili) plastičnosti tijekom obrade i rada.
Primjena u medicini
Krajem 19. i početkom 20. stoljeća, kada je organska sinteza napravila prve korake, mnogi esteri su sintetizirani i ispitani od strane farmakologa. Oni su postali osnova takvih lijekova kao što su salol, validol itd. Metil salicilat je naširoko korišten kao lokalni iritantan i analgetik, koji je sada praktički zamijenjen učinkovitijim lijekovima.
Priprava estera
Esteri se mogu dobiti reakcijom karboksilnih kiselina s alkoholima ( reakcija esterifikacije). Katalizatori su mineralne kiseline.
Video “Priprema etil acetil etera”
Videozapis “Priprema boronetil etera”
Reakcija esterifikacije pod kiselom katalizom je reverzibilna. Obrnuti proces - cijepanje estera pod djelovanjem vode u karboksilnu kiselinu i alkohol - naziva se hidroliza estera.
RCOOR" + H2O (H+)↔ RCOOH + R"OH
Hidroliza u prisutnosti lužine je ireverzibilna (budući da nastali negativno nabijeni karboksilatni anion RCOO ne reagira s nukleofilnim reagensom - alkoholom).
Ova reakcija se zove saponifikacija estera(po analogiji s alkalnom hidrolizom esterskih veza u mastima pri proizvodnji sapuna).
Sada razgovarajmo o onim teškim. Esteri su široko rasprostranjeni u prirodi. Reći da esteri igraju veliku ulogu u ljudskom životu znači ne reći ništa. Susrećemo ih kada mirišemo cvijet čija je aroma zaslužna najjednostavnijim esterima. Suncokretovo ili maslinovo ulje također je ester, ali velike molekularne težine – baš kao i životinjske masti. Peremo, peremo i peremo proizvodima koji su dobiveni kemijskom reakcijom prerade masti, odnosno estera. Također se koriste u raznim područjima proizvodnje: koriste se za izradu lijekova, boja i lakova, parfema, maziva, polimera, sintetičkih vlakana i još mnogo, mnogo više.
Esteri su organski spojevi koji se temelje na organskim karboksilnim ili anorganskim kiselinama koje sadrže kisik. Struktura tvari može se prikazati kao molekula kiseline u kojoj je H atom u hidroksilnom OH- zamijenjen radikalom ugljikovodika.
Esteri se dobivaju reakcijom kiseline i alkohola (reakcija esterifikacije).
Klasifikacija
 - Voćni esteri su tekućine voćnog mirisa, molekula ne sadrži više od osam ugljikovih atoma. Dobiva se iz monohidričnih alkohola i karboksilnih kiselina. Esteri cvjetnog mirisa dobivaju se pomoću aromatskih alkohola.
- Voćni esteri su tekućine voćnog mirisa, molekula ne sadrži više od osam ugljikovih atoma. Dobiva se iz monohidričnih alkohola i karboksilnih kiselina. Esteri cvjetnog mirisa dobivaju se pomoću aromatskih alkohola.
- Voskovi su čvrste tvari koje sadrže od 15 do 45 C atoma po molekuli.
- Masti - sadrže 9-19 atoma ugljika po molekuli. Dobiva se iz glicerina a (trohidrični alkohol) i viših karboksilnih kiselina. Masti mogu biti tekuće (biljne masti zvane ulja) ili krute (životinjske masti).
- Esteri mineralnih kiselina po svojim fizikalnim svojstvima također mogu biti ili uljaste tekućine (do 8 ugljikovih atoma) ili krutine (od devet C atoma).
Svojstva
U normalnim uvjetima esteri mogu biti tekući, bezbojni, voćnog ili cvjetnog mirisa ili čvrsti, plastični; obično bez mirisa. Što je duži lanac ugljikovodičnog radikala, tvar je tvrđa. Gotovo netopljiv. Dobro se otapaju u organskim otapalima. Zapaljivo.
Reagirati s amonijakom pri čemu nastaju amidi; s vodikom (ta reakcija pretvara tekuća biljna ulja u čvrste margarine).
Kao rezultat reakcija hidrolize, razlažu se na alkohol i kiselinu. Hidroliza masti u alkalnom okruženju dovodi do stvaranja ne kiseline, već njezine soli - sapuna.
Esteri organskih kiselina su niskotoksični, imaju narkotički učinak na ljude i uglavnom pripadaju 2. i 3. razredu opasnosti. Neki reagensi u proizvodnji zahtijevaju upotrebu posebne zaštite za oči i disanje. Što je molekula etera duža, to je otrovnija. Esteri anorganske fosforne kiseline su otrovni.
Tvari mogu ući u tijelo putem dišnog sustava i kože. Simptomi akutnog trovanja su uznemirenost i poremećaj koordinacije pokreta, praćeni depresijom središnjeg živčanog sustava. Redovito izlaganje može dovesti do bolesti jetre, bubrega, kardiovaskularnog sustava i poremećaja krvi.
Primjena
U organskoj sintezi.
- Za proizvodnju insekticida, herbicida, maziva, impregnacija za kožu i papir, deterdženata, glicerina, nitroglicerina, sušivih ulja, uljanih boja, sintetičkih vlakana i smola, polimera, pleksiglasa, plastifikatora, reagensa za obogaćivanje ruda.
- Kao dodatak motornim uljima. 
- U sintezi parfumerijskih mirisa, prehrambenih voćnih esencija i kozmetičkih aroma; lijekovi, na primjer, vitamini A, E, B1, validol, masti.
- Kao otapala za boje, lakove, smole, masti, ulja, celulozu, polimere.
U asortimanu trgovine Prime Chemicals Group možete kupiti popularne estere, uključujući butil acetat i Tween-80.
Butil acetat
Koristi se kao otapalo; u parfumerijskoj industriji za proizvodnju mirisa; za štavljenje kože; u farmaceutici - u procesu proizvodnje određenih lijekova.
Blizanac-80
To je također polisorbat-80, polioksietilen sorbitan monooleat (na bazi sorbitola maslinovog ulja). Emulgator, otapalo, tehničko mazivo, modifikator viskoznosti, stabilizator eteričnih ulja, neionski surfaktant, humektant. Uključeno u otapala i tekućine za rezanje. Koristi se za proizvodnju kozmetičkih, prehrambenih, kućanskih, poljoprivrednih i tehničkih proizvoda. Ima jedinstveno svojstvo pretvaranja mješavine vode i ulja u emulziju.